Pigmentos de Dióxido de Titânio
O dióxido de titânio (TiO
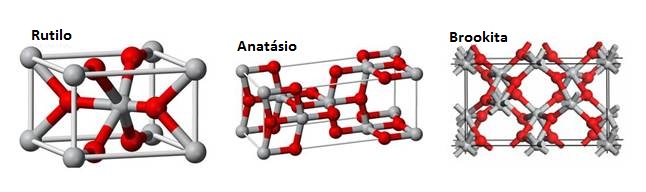
2) é de longe o pigmento branco mais utilizado no mundo graças as suas propriedades de dispersão (é superior a qualquer outro pigmento branco), estabilidade química e atoxidade. Sua superfície é sempre polar e, sua dispersabilidade e resistência às intempéries, são influenciadas por seus grupos hidroxilas. Ocorre na natureza nas fases rutilo, anatásio (ou anatase) e brookita, sendo as formas de rutilo e anatásio produzidas industrialmente em larga escala.
Rutilo, anatásio e brookita são as nomenclaturas para cada forma em que a estrutura química do dióxido de titânio se apresenta. O átomo de titânio é cercado octaedralmente por seis átomos de oxigênio, e cada átomo de oxigênio é cercado por três átomos de titânio num arranjo trigonal. As diferentes maneiras como o octaedro é ligado a seus lados e cantos definem qual das três formas o dióxido de titânio pertence.
O dióxido de titânio fica amarelado acima de 400°C devido à expansão térmica da estrutura e, acima de 1000°C, oxigênio é liberado, aumentando a pressão e formando óxidos inferiores de titânio. O ponto de fusão do TiO
2 fica na casa dos 1800°C.
Quanto a resistência química, o TiO
2 é muito estável e não é atacado pela maioria dos reagentes orgânicos e inorgânicos. Se dissolve em ácido sulfúrico concentrado e em ácido hidrofluórico, e é atacado e dissolvido por materiais ácidos e alcalinos fundidos. Sob altas temperaturas, o TiO
2 reage com agentes redutores tais como o monóxido de carbono, hidrogênio e amônia para formar óxidos de titânio de menor valência (titânio metálico não é formado). Acima de 500°C o dióxido de titânio reage com o cloro na presença de carbono para formar tetracloreto de titânio.
O TiO
2 rutilo tem a densidade e rigidez mais alta (6,5 a 7 Mohs) e uma estrutura atômica mais compacta, enquanto o anatásio é consideravelmente mais flexível (5,5 Mohs).
O titânio é o nono elemento mais abundante na crosta terrestre, e é sempre encontrado em combinação com o oxigênio na forma de minerais, sendo os mais importantes economicamente a ilmenita, o leucoxênio (que é uma alteração da ilmenita) e o rutilo.
A ilmenita é encontrada em depósitos minerais e principalmente na areia de praia, frequentemente misturada com ferro e outros minerais. Essa areia passa então por processos gravitacionais, para obter um concentrado de minerais pesados; magnéticos, para separar a ilmenita do rutilo, zircão e silicatos; e eletrostáticos, para separar impurezas não-condutoras como granitos, silicatos e fosfatos. A fração não-magnética (leucoxênio, rutilo e zircão) passa ainda por um processo hidromecânico (mesa agitadora e espirais) para remover os minerais de baixa densidade remanescentes como o quartzo.
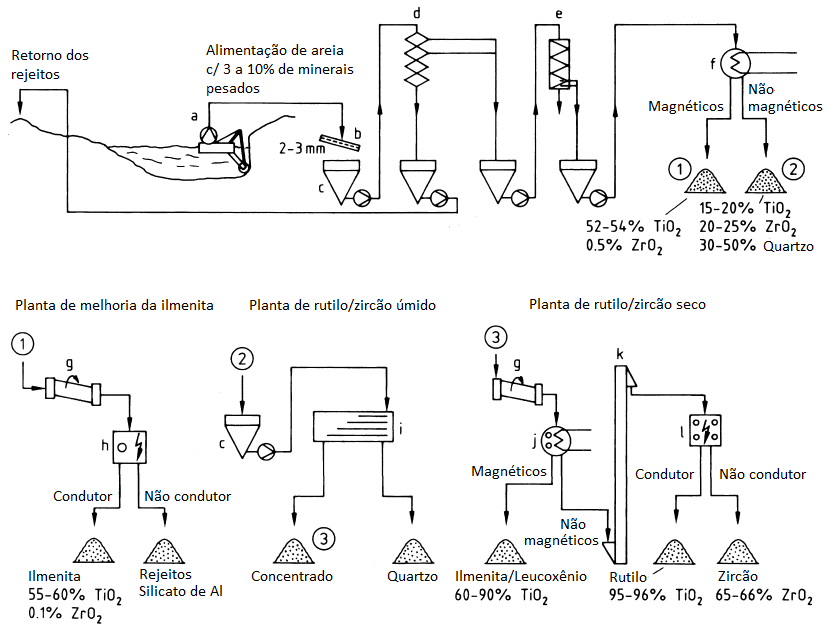 Processamento de areia pesada. a) Draga; b) Peneira; c) Dosador; d) Cones de Reichert; e) Espirais; f) Separador magnético; g) Secador; h) Separador eletrostático; i) Mesa agitadora; j) Separador magnético seco; k) Esteira transportadora vertical; l) Separador eletrostático
Processamento de areia pesada. a) Draga; b) Peneira; c) Dosador; d) Cones de Reichert; e) Espirais; f) Separador magnético; g) Secador; h) Separador eletrostático; i) Mesa agitadora; j) Separador magnético seco; k) Esteira transportadora vertical; l) Separador eletrostático
Já as reservas de rutilo natural não são suficientes para atender a demanda mundial, pois esse minério só aparece com frequência na areia, sempre em pequenas quantidades entre a ilmenita e outros minerais pesados. Também pode ser encontrada na cristalização do magma, porém em quantidade muito baixa para aproveitamento comercial.
Devido à dificuldade de se obter o TiO
2 rutilo naturalmente, vários processos foram desenvolvidos para se produzir o rutilo sintético, todos eles baseados na redução de Fe
3+ com carbono e hidrogênio, na qual o Fe
2+ formado é tratado com ácido clorídrico ou sulfúrico diluído (de preferência sob pressão) chegando-se assim ao rutilo sintético com 85~96% de TiO
2.
Propriedades do dióxido de titânio
Refração – os índices de refração do rutilo e anatásio são notáveis: respectivamente, n = 2,80 e 2,55, valores mais altos que o do diamante (n = 2,42), e mesmo após a incorporação em diversos tipos de materiais seu coeficiente de refração se mantém entre 1,5 e 2.
Cor – a brancura do TiO
2 vai depender principalmente da modificação cristalina, da pureza, e do tamanho de partícula. Partículas menores dispersam a luz com comprimentos de onda mais curtos e, portanto, mostram um leve tom azulado, enquanto as partículas maiores exibem um tom mais amarelado (o tamanho máximo do TiO
2 é de 0,2μm). Como a banda de absorção (385nm) do TiO
2 anatásio está deslocada para a região UV em comparação com o rutilo, ele é menos amarelado. Deve-se destacar que o processo de produção do pigmento também possui uma grande influência nessa propriedade, pois os pigmentos produzidos pelo processo de cloração (o qual inclui a purificação por destilação de TiCl
4 antes do passo de oxidação) têm uma alta pureza de cor e alto brilho.
Dispersão – para que o TiO
2 obtenha uma boa desintegração e dispersão, atingindo assim, um alto grau de brilho, é necessário um tratamento da superfície do pigmento, geralmente com compostos de Zr, Ti, Al e Si numa proporção de menos de 3%.
Resistência às intempéries – a exposição às intempéries pode levar ao aparecimento de manchas ou acinzentar a superfície do produto tingido com TiO
2, principalmente com pigmentos anatásios.
Bibliografia:
BUXBAUM, Gunter; PFAFF, Gerhard. Industrial Inorganic Pigments. 3.ed. Weinheim: Wiley-VCH, 2005.
HARPER, Charles A.; PETRIE, Edward M. Plastics Materials and Process: A Concise Encyclopedia. Hoboken: John Wiley & Sons, Inc., 2003.
© 2010-2024 - Tudo sobre Plásticos.
Todos os direitos reservados.
Página inicial
-
Política de privacidade
-
Contato